生体情報・治療システム研究部門:Division of Bioinformation and Therapeutic Systems
研究上の強み:Research Advantage
主要研究テーマ:
- ① 防衛再生医療工学
戦傷の治療に資する再生医療研究。ヒト三次元皮膚組織培養を用いた移植再生医療技術等の開発,特に実用化に必要な基盤技術(光による細胞活性化法など)の開発に取り組んでいる。
- ② ブレインヘルスイノベーション
隊員の脳の防御,機能向上のための研究。レーザー誘起衝撃波を用いた頭部爆傷のメカニズムの解明,医学対処法の研究,光による細胞活性化を用いたストレス・脳疲労からの回復に関する研究等に取り組んでいる。
基盤技術:光・レーザーの多様・多彩な生体作用を活用し,新たな診断・イメージング,治療・制御技術の開発研究に取り組み,防衛医学上の重要課題の解決を図っている。
国際連携:爆傷研究を中心に,米軍・NATO等の他国の関係機関と連携し,国際安全保障に貢献する研究活動を推進している。
メンバー:Staff
研究目的・方針:Mission
光・レーザーの多様・多才な生体作用を活用し,大規模災害・テロ・有事等において多発が想定される各種外傷患者,戦傷病患者の救命,ならびにQOL(生活の質)の向上を目的とした診断・治療技術,さらに特殊環境下における自衛隊員等の安全確保を目的とした生体モニタリング技術の実用化を目指した研究を推進します。これら目的達成のため,積極的に学内の講座等,自衛隊の関係部署,米軍等との連携に取り組みます。
主要研究テーマ:Main Research Topics
- ⑴ 熱傷診断・治療技術の開発
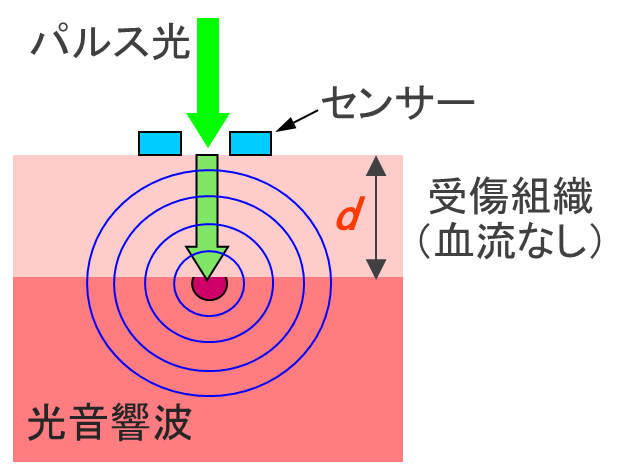
図1 光音響法による熱傷深度診断の原理
- ① 光音響イメージング法を用いた熱傷深度診断法の開発
熱傷は受傷深度によりⅠ度,浅達性Ⅱ度,深達性Ⅱ度,Ⅲ度熱傷等に分類され,皮膚移植治療の要否,感染対策などの治療方針が大きく異なるため,正確な受傷深度診断が重要です。しかし定量的な熱傷深度診断技術は確立されておらず,その診断は専門医の肉眼的診断に委ねられていました。そこで私達は光音響イメージング法に基づく独自の熱傷深度診断法を提案し,ラット熱傷モデルを対象にその有効性を示しました(S. Sato et al., J. Trauma, 2005)。熱傷組織においては血流が遮断することから,創部に血液に吸収されやすい波長の微弱なパルス光を照射すると,光は受傷組織中を効率よく伝搬し,その下部にある非受傷組織中の血液に吸収され,断熱膨張により光音響波(超音波)を発生します。本方法はその光音響波を創部表面で検出し,その伝搬時間と既知の音速の積より受傷深度を求めます(図1)。
その後実用化を目指した橋渡し研究を進め,2013年に臨床用プロトタイプ機を試作しました。また装置の小型・低コスト化,高性能化を図るため,光源としてLED(発光ダイオード)を用いる方式の光音響診断法(Y. Tsunoi et al., Wound Rep. Reg., 2022)についても研究を行っています。
- ② 移植用三次元皮膚培養技術の開発
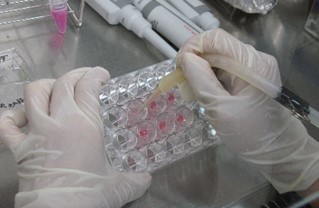
図2 三次元皮膚の培養

図3 三次元培養皮膚に対するPBMを
行っている様子
重症熱傷の皮膚移植治療においては感染防御が重要であり,そのため移植皮膚内の血行を早期に回復させる必要があります。私達は,大阪大学の明石先生らのグループが開発したヒトの細胞を用いた三次元培養皮膚(図2)に着目し,2016 年より大阪大学と共同研究を開始しました。この三次元培養皮膚は血管系を含むことから移植後早期の生着,血行再開が期待されます。一方,その実用化には,ⅰ)培養組織のバイアビリティー(活性)の向上,厚さや強度の増大,ⅱ)培養期間の短縮,ⅲ) ハンドリング技術の開発などの課題があり,これらを解決するため,光技術を活用した研究に取り組んでいます。
その一つが光生体調節作用(PBM: photobiomodulation,図3)の応用です。生体組織に可視から近赤外領域の特定波長の低強度の光を照射すると,ミトコンドリアの電子伝達反応が促進され,ATP(アデノシン三リン酸)や活性酸素の生成等が促進されます(PBM)。私達はこのPBMを培養組織のバイアビリティー向上(Y. Tsunoi et al., Photochem Photobiol, 2022)や分化促進に応用し,本技術に基づく細胞培養装置について特許を取得しました(特許第 6956340 号,2021)。
また,三次元皮膚培養は多孔質のメンブレン(膜)上で行われますが,培養した皮膚を移植のためにメンブレンから剥離すること,および剥離した柔らかい皮膚をハンドリングすることが難しいという問題がありました。そこで私達は,生分解性材料と超短パルスレーザーによる微細加工技術を用いて,メンブレンごと移植可能な,生分解性多孔質メンブレンを用いた培養・移植技術の開発を進めています。同メンブレンを用いて実際に皮膚培養を行い,移植が行えることを確認しており(Y. Tsunoi et al., Tissue Eng.: Part A, 2023),実用化が期待されます。
- ⑵ 創部感染制御・生体除染技術の開発
• 光線力学効果に基づく創部感染治療
重症熱傷などの重症外傷においては,急性期の救命に成功しても,慢性期の創部感染に起因して敗血症に至ると死亡率が高く,特に感染が薬剤耐性菌に由来する場合は有効な治療法が存在しません。そこで私達は,薬剤耐性菌にも有効性が期待される光線力学的治療(PDT: photodynamic therapy)に着目し,創部感染に起因する敗血症を予防するための技術開発を目指しています。PDTは光感受性薬剤を光励起し,薬剤分子の励起エネルギーを生体組織中の溶存酸素に移乗させて一重項酸素を生成し,その酸化力によって殺細胞効果を得る治療法であるため,薬剤耐性菌に対しても有効です。また細菌を薬剤や免疫細胞から保護する働きをするバイオフィルムを不活性化する効果も知られています(R. R. Sarker et al., Photochem Photobiol, 2021)。しかしPDTを敗血症の予防に応用した例はありませんでした。
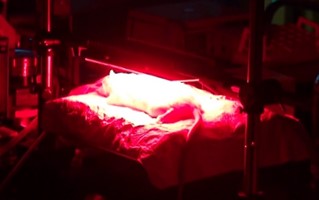
図4 ラット熱傷感染創部に対するPDT
私達はラット広範囲Ⅲ度熱傷緑膿菌感染モデルを対象に,光感受性薬剤としてメチレンブルー,光源に大面積照射が可能な LED アレイ(波長 665 ㎚)を用いた PDT を行い(図4),創部ならびに体内に侵入する菌数(血中・肝臓中の菌数)を大幅に減少させ,死亡率を有意に低下させられることを示しました。PDTは熱傷創部に対して薬剤を塗布し,非接触で光照射を行うのみの低侵襲治療であることから,臨床応用のハードルは低いと考えられ,早期の実用化が期待されます。
- ⑶ レーザー誘起衝撃波を用いた頭部爆傷の研究
爆発物を用いたテロや攻撃の多発により,爆発に起因する頭部外傷(bTBI: blast-induced traumatic brain injury)が米国を中心に大きな社会問題となっています。その特徴は,急性期に軽症と診断されながら,慢性期に高次脳機能障害,片頭痛,睡眠障害,さらにうつ,不安等の精神症状を高率に来すことにあり,心的外傷後ストレス障害(PTSD)との関連も指摘されています。これらの症状は,爆発に伴う衝撃波の脳への作用が原因と考えられていますが,bTBIの病態,メカニズムには不明な点が多く,医学対処法が確立していません。

図5 ラット頭部へのLISW適用

図6 ラット脳のマルチスペクトル
イメージング実験(S. Kawauchi et
al., J Biomed Opt, 2019)
そこで私達は,衝撃波が脳に引き起こす現象を解明するため,独自の衝撃波源であるレーザー誘起衝撃波(LISW: laser-induced shock wave)を用いた研究を進めています。LISWは,光吸収体(黒色ゴム)に高強度のパルスレーザー光を照射した際に発生するプラズマの膨張に伴って発生します(図5)。爆傷研究では,ショックチューブやブラストチューブを用いるのが最も一般的ですが,LISWは,① 純粋な衝撃波の影響を解析できる(爆風が発生しない),② 空間的に限局した衝撃波であるため生体の特定部位を標的化できる(複雑な現象の分解が可能),③ 適用部のごく近傍にセンサー類を設置できるため,衝撃波曝露時のリアルタイム観測が可能である,等の利点を有します。
そもそも,脳が衝撃波に曝露したときに起きる現象に関する報告は全くありませんでしたが,私達はラット頭部にLISWを適用して脳で起きる現象をリアルタイム観測した結果(図6),大脳皮質において拡延性脱分極(神経細胞の集団的過興奮状態が伝搬する現象)が起き,その後,酸欠状態(低酸素血症)長時間持続することがわかりました(S. Sato et al., PLoS ONE, 2014)。
また頭蓋骨直下にある髄膜(硬膜,くも膜,軟膜),特に硬膜中の血管が損傷を受けやすく(図7),これに起因して受傷後数日から数週間にわたり,活性化したグリア細胞が損傷部位に集積する現象(グリア瘢痕)を観測しました(S. Kawauchi et al., J Neurotrauma, 2024)。グリア瘢痕は,bTBI受傷者(人)の死後脳で観測されている重要な病態あり,これを模擬することに成功したことから,このモデルを用いた治療実験を開始しています。

図7 LISWを適用したラットの髄膜損傷
さらにLISWを頭部に適用したラットでは,神経軸索損傷に起因すると考えられる不安・うつ様症状も観測されています。不安と抑うつはbTBIに特徴的な臨床症状として知られ,これらの症状も再現できることがわかりました(M. Jitsu et al., Front Neurol, 2021)。
上記の論文発表(S. Sato et al., PLoS ONE, 2014)は,米軍との研究交流を開始するきっかけとなり,その一環として2016 年に米軍と共同で開始した日米爆傷フォーラムは,参加国の増加を受けて2019年の第4回目から国際爆傷対処フォーラム(International Forum on Blast Injury Countermeasures、IFBIC)となり現在に至ります。創立10周年となる第10回会目の会議(IFBIC 2026)は、2026年7月に米国で開催される予定です。
業績(令和5年度):Research Achievements (2023)
原著論文(欧文)
⑴ Kawauchi S, Kono A, Muramatsu Y, Hennes G, Seki S, Tominaga S, Haruyama Y, Komuta Y, Nishidate I, Matsukuma S, Wang Y, Sato S: Meningeal damage and interface astroglial scarring in the rat brain exposed to a laser-induced shock wave(s). J. Neurotrauma (8 Mar accepted) 2024.
⑵ Parvez A, Yashiro K, Nagahama Y, Tsunoi Y, Saitoh D, Sato S, Nishidate I: In vivo visualization of burn depth in skin tissue of rats using hemoglobin parameters estimated by diffuse reflectance spectral imaging. J. Biomed. Opt. 29: 026003, 2024. doi: 10.1117/1.JBO.29.2.026003.
⑶ Tashiro A, Bereiter DA, Ohta H, Kawauchi S, Sato S, Morimoto Y: Trigeminal Sensitization in a Closed Head Model for Mild Traumatic Brain Injury. J Neurotrauma 41: 985-999, 2024. doi: 10.1089/neu.2023.0328.
⑷ Parvez A, Yashiro K, Tsunoi Y, Saitoh D, Sato S, Nishidate I: In vivo monitoring of hemoglobin derivatives in a rat thermal injury model using spectral diffuse reflectance imaging. Burns 50: 167-177, 2024. doi: 10.1016/j.burns.2023.07.006.
⑸ Mizoguchi A, Higashiyama M, Wada A, Nishimura H, Tomioka A, Ito S, Tanemoto R, Nishii S, Inaba K, Sugihara N, Hanawa Y, Horiuchi K, Okada Y, Kurihara C, Akita Y, Narimatu K, Komoto S, Tomita K, Kawauchi S, Sato S, Hokari R: Visceral hypersensitivity induced by mild traumatic brain injury via the corticotropin-releasing hormone receptor: An animal model. Neurogastroenterol Motil. 35: e14634, 2023. doi: 10.1111/nmo.14634.
⑹ Tsunoi Y, Kawauchi S, Yamada N, Araki K, Tsuda H, Sato S: Transvascular Delivery of Talaporfin Sodium to Subcutaneous Tumors in Mice by Nanosecond Pulsed Laser-induced Photomechanical Waves. Photodiagnosis Photodyn. Ther. 44: 103861, 2023. doi: 10.1016/j.pdpdt.2023.103861.
⑺ Tsunoi Y, Tsuda H, Kawauchi S, Araki K, Sato S: Enhanced Therapeutic Effects of an Antitumor Agent on Subcutaneous Tumors in Mice by Photomechanical Wave-based Transvascular Drug Delivery. J. Cancer. 14: 1773-1780, 2023. doi: 10.7150/jca.84066.
⑻ Tsunoi Y, Takayama I, Kondo N, Nagano Y, Miyazaki H, Kawauchi S, Akashi M, Saitoh S, Terakawa M, Sato S: Cultivation and Transplantation of 3-dimensional Skins with Laser-processed Biodegradable Membranes. Tissue Eng Part A. 29: 344-353, 2023. doi: 10.1089/ten.TEA.2022.0208.
⑼ Kawauchi S, Inaba M, Muramatsu Y, Kono A, Nishidate I, Adachi T, Cernak I, Sato S: In vivo imaging of nitric oxide in the male rat brain exposed to a shock wave. J Neurosci Res. 101: 976-989, 2023. doi: 10.1002/jnr.25172.
学会発表(国外)
⑴ Tsunoi Y, Takayama I, Kondo N, Nagano Y, Miyazaki H, Ida T, Akashi M, Terakawa M, Sato S. Femtosecond laser-processed biodegradable porous membranes for cultivation and transplantation of three-dimensional skin substitutes. SPIE Photonics West 2024 Biomedical Optics 2024.01-2024.02.
⑵ Tsunoi Y, Tsuda H, Araki K, Sato S. Transvascular delivery of cisplatine to subcutaneous tumors in mice by photomechanical waves. SPIE Photonics West 2024 Biomedical Optics 2024.01-2024.02.
⑶ Murakami R, Wang Y, Tsumura R, Tang Y, Tsunoi Y, Nycz CJ, Lesniak WG, Pomper MG, Fischer GS, Zhang HK. MRI-Compatible Transrectal Photoacoustic and Ultrasound Imaging System with Remote Mechanical Actuation. IEEE International Ultrasonic Symposium 2023 2023.09.
⑷ Tsunoi Y, Miyazaki H, Kawauchi S, Saitoh D, Akashi M, Sato S. Control of the viability of three-dimensional cultured skins by photobiomodulation. European Conferences on Biomedical Optics 2023 2023.06.
⑸ Murakami R, Wang Y, Tsumura R, Tang Y, Tsunoi Y, Nycz CJ, Lesniak WG, Pomper MG, Fischer GS, Zhang HK. Towards MRI-compatible photoacoustic imaging of prostate cancer: Instrumentation evaluation. International Symposium on Ultrasonic Imaging and Tissue Characterization 2023.06.
⑹ Yanagihara Y, Kondo Y, Kawai M, Koiwai T, Nakao R, Kiyohara S, Hasegawa S, Morichika K, Kawauchi S, Tsunoi Y, Sato S, Suzuki H. Modeling of the shock wave generated by a projectile impact on a body armor with LISW (laser-induced shock wave). 7th International Forum on Blast Injury Countermeasures 2023 (IFBIC 2023) 2023.05.
⑺ Kawauchi S, Nozawa T, Kohno A, Muramatsu Y, Nishidate I, Sato S. Impairment of glymphatic clearance in the rat brain exposed to a laser-induced shock wave. 7th International Forum on Blast Injury Countermeasures 2023 (IFBIC 2023) 2023.05.
⑻ Kawauchi S, Inaba M, Muramatsu Y, Kono A, Nishidate I, Adachi T, Cernak I, Sato S. In vivo imaging of cerebrovascular nitric oxide generation in the rat brain exposed to a laser-induced shock wave. 7th International Forum on Blast Injury Countermeasures 2023 (IFBIC 2023) 2023.05.
⑼ Sato S, Kawauchi S. The role of laser-induced shock wave (LISW) in blast injury research. 7th International Forum on Blast Injury Countermeasures 2023 (IFBIC 2023) 2023.05.
学会発表(国内)
⑴ 田邊静香, 角井泰之, 宮﨑裕美, 明石満, 佐藤俊一. ヒト 3 次元培養皮膚を用いた抗微生物光線力学療法の副作用に関する評価. 第23回レーザー学会東京支部研究会 2024.03.
⑵ 川内聡子. 謎の中枢神経障害:ハバナシンドロームと湾岸戦争シンドローム. 第29回日本脳神経外科救急学会 2024.02.
⑶ 角井泰之. 光音響イメージング法の皮膚診断応用. 次世代センサ·アクチュエータ委員会第32回定期講習会 2023.12.
⑷ 角井泰之, 長野陽, 宮﨑裕美, 明石満, 寺川光洋, 佐藤俊一. 超短パルスレーザー加工により作製した生分解性多孔質膜を用いたヒト 3 次元皮膚の培養· 移植. Laser Week in Tokyo IV 2023.11.
⑸ 川内聡子, 野澤孝司, 幸野明美, 村松佑里子, 西舘泉, 佐藤俊一. ラット脳への衝撃波曝露が老廃物排出系(Glymphatic system)に与える影響. Laser Week in Tokyo IV 2023.11.
⑹ 角井泰之, 関根康雅, 齋藤大蔵, 佐藤俊一. 光線力学療法による熱傷創の感染制御:ラット広範囲熱傷モデルを対象とした研究. 第 49 回日本熱傷学会総会· 学術集会 2023.05
報告書:Research Report














